Istnieje wiele chorób i dolegliwości, które od dawna są opisane i diagnozowane, jednak wciąż nie ma leków, które pozwoliłyby na skuteczne wyleczenie lub wyeliminowanie nawrotów. Jest to, chociażby cukrzyca typu II, reumatoidalne zapalenie stawów, czy wrzodziejące zapalenie jelit. Dlatego tak ważna jest nieustanna praca nad rozwojem medycyny i opracowywanie nowych preparatów. Aby mogły być dostępne dla wszystkich zmagających się z chorobami, muszą przejść badania kliniczne i zostać wprowadzone do obrotu. Czym są wspomniane badania i w jaki sposób są przeprowadzane? Czy są bezpieczne? Jakie korzyści płyną ze wzięcia w nich udziału przez ochotników?
Czym są badania kliniczne?
Badania kliniczne to szczególny rodzaj badań i procedur prowadzony z udziałem ludzi w celu odkrycia, określenia oraz potwierdzenia farmakologicznych, lub klinicznych skutków działania danej substancji, zabiegów, czy terapii. Podczas procedur identyfikuje się również ewentualne działania niepożądane i występowanie reakcji z innymi lekami lub pokarmami. Badany jest cały proces metabolizmu preparatu, jego wchłanianie i wydalanie. Podczas badań określane jest bezpieczeństwo stosowania substancji, dokładne dawkowanie i skuteczność działania w stosunku do wskazań stosowania leku.
Badania kliniczne w Klinice OT.CO
Bezpieczeństwo, zdrowie i dobro ochotników
Naczelną zasadą wszystkich badań klinicznych jest zdrowie i dbanie o bezpieczeństwo ochotników biorących udział w procedurze. Na każdym etapie pozostają pod ścisłą opieką sztabu specjalistów, a ich parametry oraz ogólny stan zdrowia są regularnie monitorowane. Znajduje tu zastosowanie naczelna zasada medycyny „primum non nocere” – po pierwsze nie szkodzić. Dlatego zdrowie pacjenta jest w trakcie badań klinicznych nadrzędne w stosunku do nauki i testowania danej substancji.
Ponadto pacjenci biorący udział w badaniach klinicznych chronieni są przez szereg niezależnych instytucji, takich jak FDA (Food And Drug Administration), czy Europejską Agencję Leków (EMA). Każdy etap prowadzonych badań jest zatem szczegółowo monitorowany i dokumentowany, a następnie raportowany ściśle z określonymi wytycznymi.
Skąd wiemy, co jest w preparacie podawanym ochotnikom? Czy to bezpieczne?
Zanim dojdzie do jakichkolwiek badań klinicznych z udziałem ludzi, substancja przechodzi szereg wnikliwych badań przedklinicznych, procedur laboratoryjnych i testów.
Kiedy produkt leczniczy zostanie określony w swoim składzie, przeprowadzane są badania in vitro, których dokonuje się w warunkach laboratoryjnych na wyizolowanych z organizmu żywych komórkach. Następnym etapem jest przeprowadzenie testów na zwierzętach. Ma to na celu ocenę wpływu preparatu na żywy, funkcjonujący organizm. Jeżeli procedury te zakończą się sukcesem, wówczas produkt leczniczy dopuszczony zostaje do badań klinicznych z udziałem ludzi, gdzie zaczyna się od podawania możliwie najniższych dawek, przy jednoczesnym szczegółowym badaniu reakcji.
Rekrutacja chętnych do badań klinicznych. Jak przebiega?
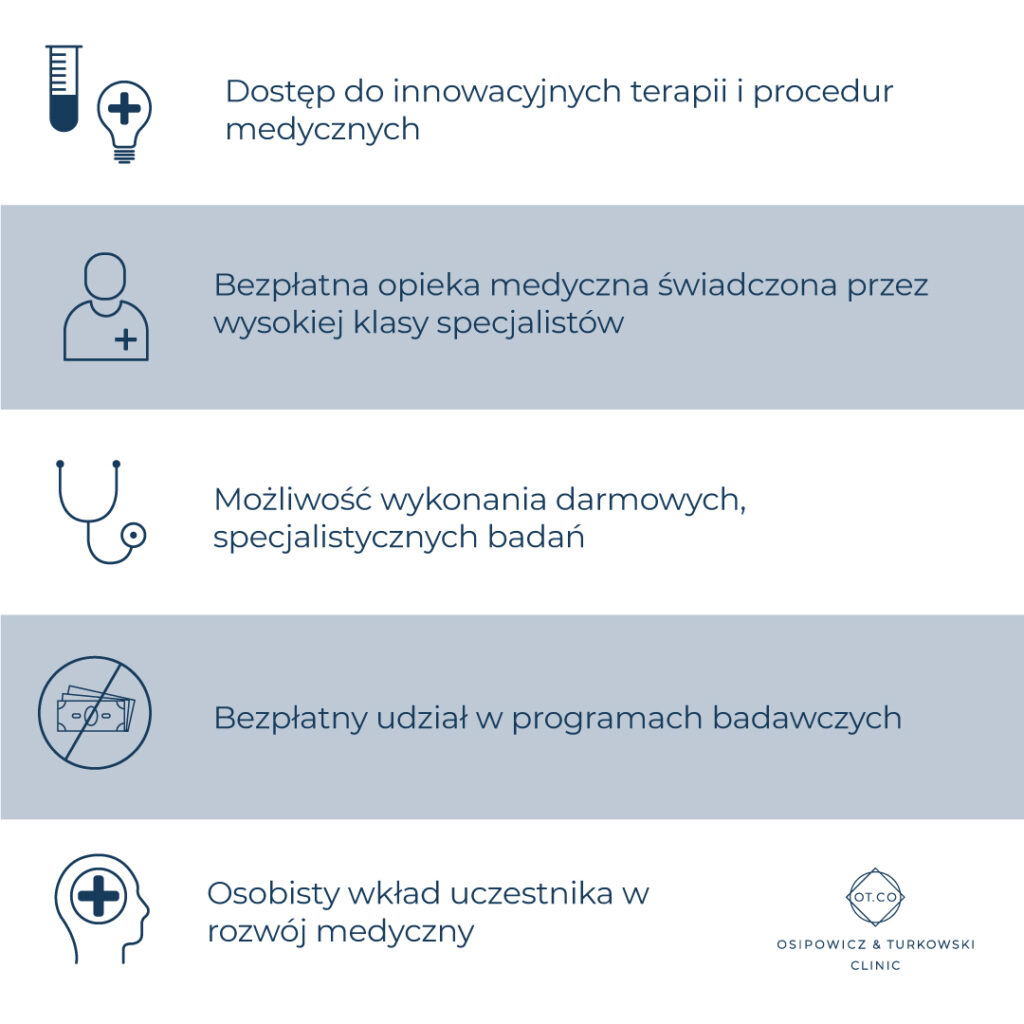
W badaniach klinicznych biorą udział osoby, które dobrowolnie zgłosiły chęć udziału w przedsięwzięciu. Muszą one spełniać określone warunki, które stanowią predyspozycje do danych badań. Przykładowo, w badaniach klinicznych dotyczących preparatu na problemy skórne, nie będzie mogła wziąć udziału osoba, której skóra jest w doskonałej kondycji i nie potrzebuje żadnych medykamentów.
Osoba chętna spełniająca kryteria projektu badań klinicznych otrzymuje szczegółowe informacje na temat procedur, które będą jej dotyczyły. Zostaje jej przedstawiony plan całego eksperymentu, poszczególne etapy i informacje na temat wskazań do stosowania preparatu. Jeżeli dana osoba po zaczerpnięciu tej wiedzy nadal jest chętna do wzięcia udziału w badaniach, wówczas podpisuje specjalny formularz świadomej zgody.
Ochotnik na czas prowadzenia badań klinicznych otrzymuje pełne ubezpieczenie, zapewniona jest mu anonimowość oraz pełny dostęp do informacji o jego stanie zdrowia, które będzie mógł uzyskać na każdym etapie prowadzonych procedur. W każdym momencie eksperymentu pacjentowi przysługuje prawo do rezygnacji z badań bez podawania przyczyny, bez ponoszenia żadnych konsekwencji.
Czy ochotnik to „królik doświadczalny”?
Niestety wciąż w wielu kręgach społecznych panuje błędne przekonanie, że badania kliniczne to forma testowania na ludziach preparatów o nieznanym pochodzeniu, które mogą wywołać szereg kolosalnych skutków ubocznych. Jest to mit. Najważniejszym ogniwem w trakcie całych badań klinicznych jest pacjent, który podlega pełnej ochronie zarówno zdrowotnej, jak i prawnej.
Sama idea badań klinicznych również ma na celu czynić dobro i rozwijać medycynę dla ludzi, aby udostępnić innowacyjne środki do leczenia schorzeń, które determinują życie ogromnej liczbie pacjentów, uniemożliwiając im cieszenie się życiem i funkcjonowanie bez bólu.
Przebieg badań klinicznych
Badania kliniczne podlegają zasadom tzw. Dobrej Praktyki Klinicznej. Kontrolowane są jednocześnie przez kilka niezależnych instytucji, a ich start zatwierdzony musi być przez Komisję Bioetyczną. Badania kliniczne przeprowadzane są w trzech głównych etapach.
Pierwszy etap to wstępna ocena bezpieczeństwa stosowania preparatu. W przypadku badania szczepionki lub nowego schematu leczenia zazwyczaj udział bierze grupa kilkudziesięciu osób zdrowych. Jeżeli badany jest nowy lek np. na chorobę nieuleczalną, do badania przystępują osoby chore na określone schorzenie. Ten etap działania rozpoczyna się od podawania pacjentom stopniowo coraz większych dawek leku pod ścisłą kontrolą reakcji organizmu. Pozwala to uzyskać wstępne informacje na temat tego, czy preparat posiada wartość terapeutyczną. Pierwsza faza badań odbywa się zazwyczaj w ośrodkach instytucji naukowych, firmach farmaceutycznych lub specjalnych centrach badawczych.
Drugi etap badań klinicznych to dalsza kontrola bezpieczeństwa stosowania substancji i określenie występowania ewentualnych efektów ubocznych lub toksycznych. Faza ta ma na celu również uzyskanie naukowej odpowiedzi na pytanie, czy badany preparat działa w danej grupie chorych. Tutaj udział bierze zazwyczaj kilkuset ochotników. Stosowana jest metoda tzw. ślepej próby, polegająca na utrzymywaniu w tajemnicy zarówno przed podającym lek, jak i przyjmującym go, czy w aktualnej dawce znajduje się badana substancja, czy zwykłe placebo. Takie działania pozwalają na uzyskanie rzetelnych, miarodajnych i subiektywnych wyników, co do faktycznych właściwości leczniczych preparatu. Na tym etapie ostatecznie ustalony zostaje schemat dawkowania leku, dokładne parametry co do wchłaniania, wydalania i metabolizmu substancji oraz ewentualne rodzaje skutków ubocznych. Drugi etap zostanie zakończony w momencie ustalenia, że korzyści płynące z przyjmowania preparatu znacznie przewyższają możliwe skutki uboczne. Wniosek ten poparty musi być szeregiem szczegółowej dokumentacji.
Trzeci etap badań klinicznych to ostateczne potwierdzenie skuteczności określonych wcześniej schematów dawkowania leku oraz opisanie szczegółowo przeciwwskazań do jego stosowania. To również moment, w którym udokumentować i udowodnić trzeba bezpieczeństwo i skuteczność stosowania badanej substancji u przeciętnego pacjenta. W trzeciej fazie badań klinicznych porównuje się całą zebraną dokumentację na temat działania leku na dane schorzenie ze skutecznością innych substancji z tej samej grupy. Na tym etapie w badaniach bierze udział nawet kilka tysięcy ochotników z różnych krajów. Może trwać nawet kilka lat, ze względu na sprawdzanie skuteczności i bezpieczeństwa preparatu zarówno w leczeniu krótkotrwałym, jak i długotrwałym. Jeżeli wyniki tych działań dowodzą skuteczności działania substancji i jest korzystniejsza niż podobne, istniejące już na rynku leki, wówczas można produkt zarejestrować i wprowadzić do ogólnego obrotu.
Niekiedy w związku z badaniami klinicznymi wyróżnia się również czwarty etap, który polega na monitorowaniu działania wprowadzonej na rynek substancji. To również metody prowadzące do udoskonalenia produktu, określenia kolejnych wskazań do stosowania, czy udostępnienia kolejnych wersji z inną dawką, lub np. w wersji smakowej, w zależności od charakteru preparatu.
Wiarygodność badań klinicznych. Czy warto wziąć w nich udział?
Nad wiarygodnymi wynikami badań klinicznych czuwają wspomniane instytucje oraz organy rządowe ds. rejestracji leków. Powstało również wiele programów i dostępnych jest mnóstwo opinii osób, które w takich procedurach brały czynny udział jako ochotnicy.
Badania kliniczne niosą ze sobą szereg zalet. Przede wszystkim udział w nich pozwala na korzystanie z innowacyjnych technologii i specjalistycznych terapii pod okiem wykwalifikowanej kadry medycznej. To szansa na wygranie z chorobą, z którą bezskutecznie wielu ludzi zmaga się od lat. Badania są ponadto bezpłatne, podobnie jak cała opieka zdrowotna związana z nimi i monitorowaniem stanu zdrowia. Darmowe są również leki, które pacjent przyjmuje na całym etapie badań. Poza dostępem do terapii w pierwszej kolejności i szansą na zażegnanie dolegliwości chorobowych uczestnik badań zyskuje swój indywidualny wkład w rozwój nauki i medycyny. Tym samym przyczynia się do polepszenia bytu i stanu zdrowia całego społeczeństwa.